
研究内容
■臨床研究
当研究室にて施行する倫理研究は以下になります。
・課題名 :精神神経疾患の病態解明のための脳神経線維束の解剖学的研究
・ 課題名 :MRIを用いた高次視覚情報処理に関する神経線維束の研究
■研究紹介
神経グループと生殖生物医学の研究グループがあります。
❖神経グループ
◆脳神経束ネットワーク(Tract-based connectome)の解析
以下、①、②、③、④の研究成果を紹介します。
①「視床」は脳皮質のサブネットワークのコネクターハブ(Connector hub)
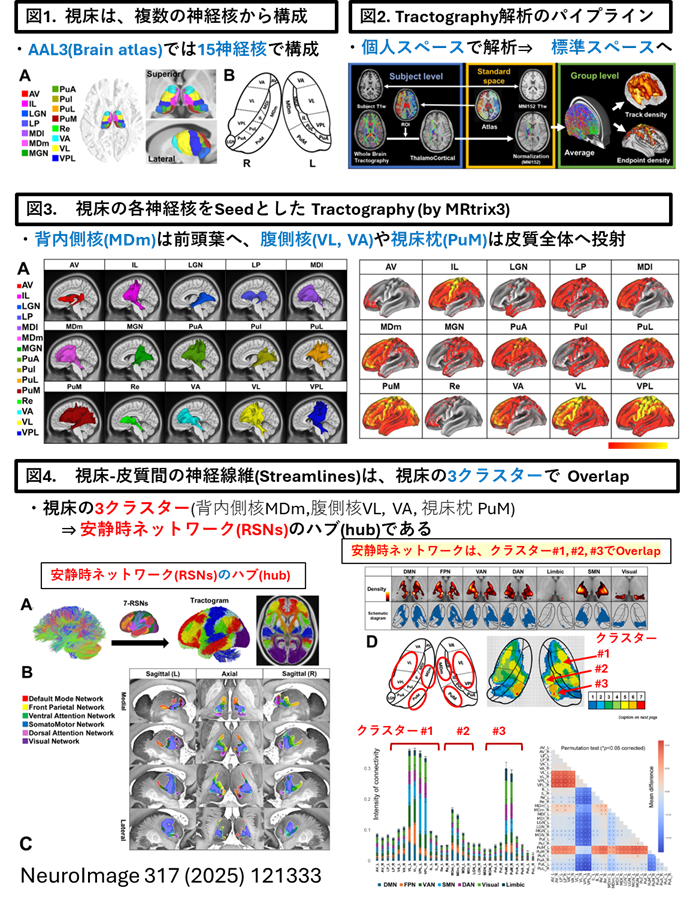
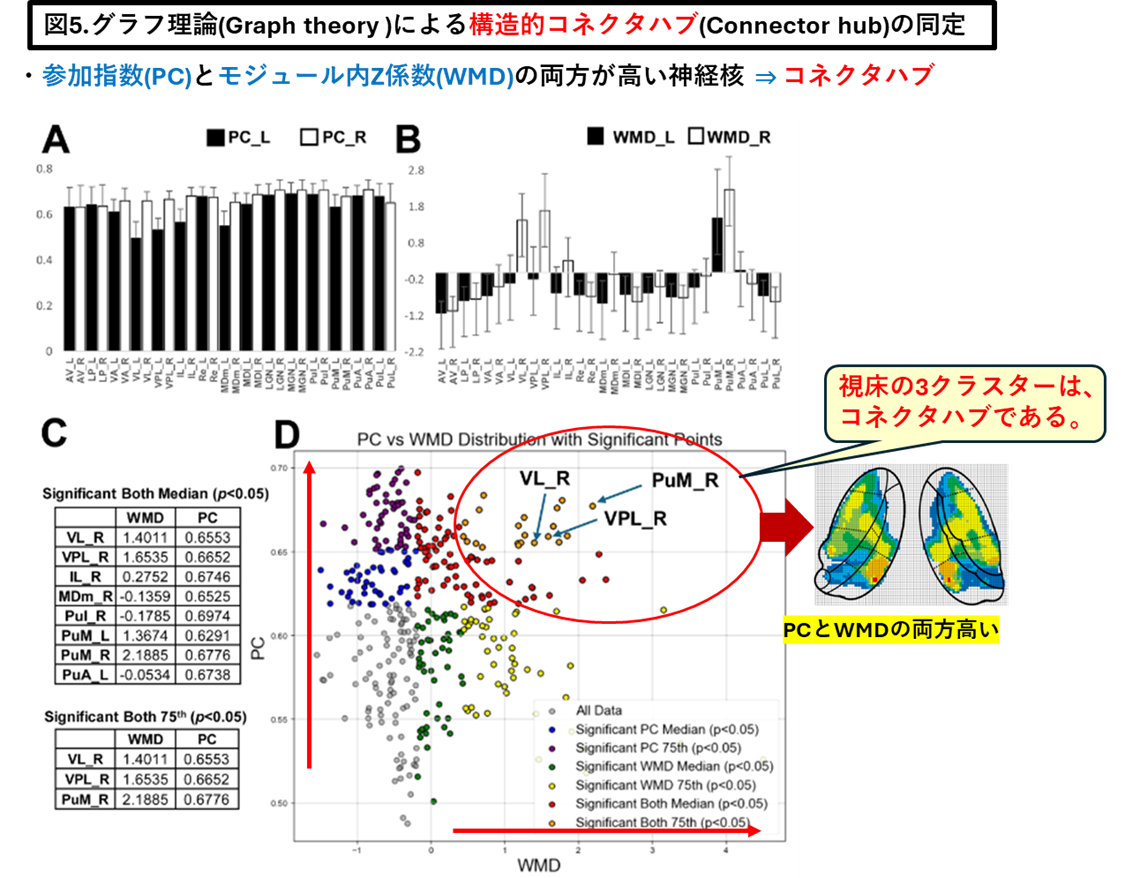
「視床」が脳皮質のサブネットワークのコネクターハブ(Connector hub)であることを見出し報告しました(Neuroimage. 2025 Aug 15;317:121333)
・ヒトが外部環境に適応するときに、ヒト脳内のサブネットワークの”分離と統合”が行われ、局所処理と分散処理が可能になると考えられます(Sporns, 2013)。 この”分離と統合”を制御するがコネクターハブ(Connector hub)です(Gordon et al., 2018, Cell Reports 24, 1687–1695)。
・当研究室は、視床-皮質結合性(ThalamoCortical conenctivity)のコネクトーム解析とグラフ理論(Graph theory)を融合させ、視床内の3クラスター(神経核の集合体)が安静時ネットワークのコネクターハブであることを報告しました(Neuroimage. 2025 Aug 15;317:121333)。
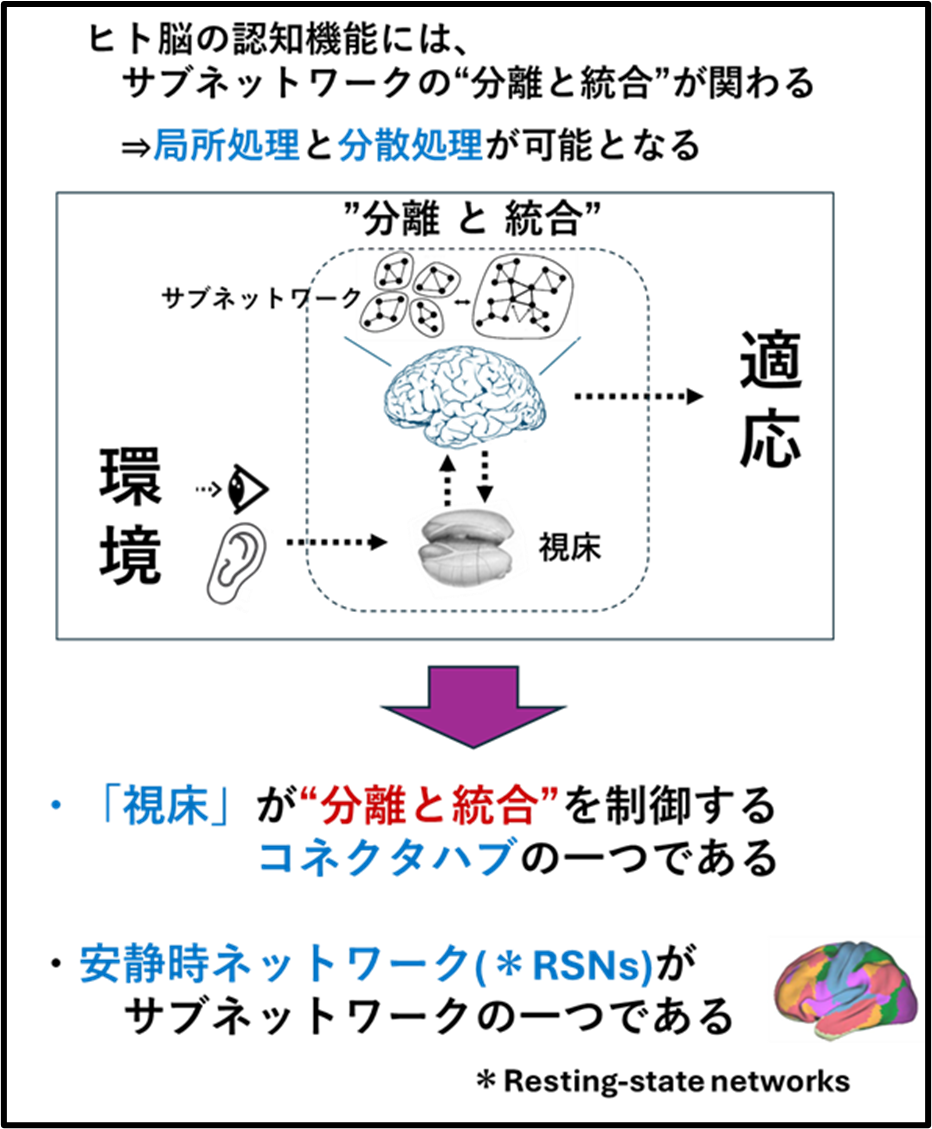
以下が論文の内容です。
*参考文献
Structural connector hub properties of the thalamus in large-scale brain networks: white matter structure as an anatomical basis.
Jitsuishi T, Yamaguchi A.
Neuroimage. 2025 Aug 15;317:121333. doi: 10.1016/j.neuroimage.2025.121333. Epub 2025 Jun 17.
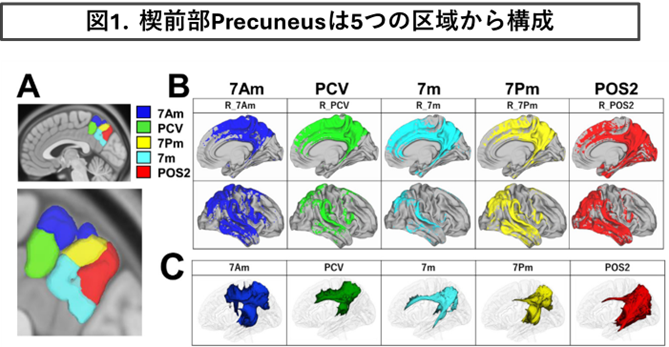
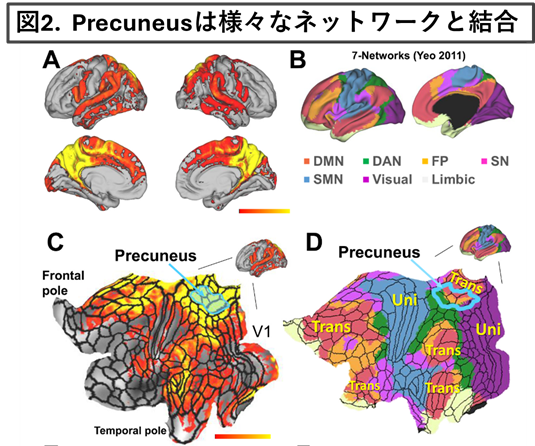
②楔前部Precuneusの神経束ネットワークの解析
・2021年-2022年度、新学術領域研究「時間生成学 時を生み出すこころの仕組み」の公募研究班で楔前部Precuneusの神経束ネットワークの解析を行いました。
・公募研究 新学術領域研究「時間生成学 時を生み出すこころの仕組み」 (chronogenesis.org)
・頭頂葉内部に位置するPrecuneusは、5つの領域に分割され様々な安静時ネットワークと構造的結合性を有し、多機能に認知機能に関与する可能性を提唱しました。
*参考文献 A. Yamaguchi and T. Jitsuishi Neuroscience Research 209 (2024) 9–17
③ヒト脳の新規の神経束の同定と機能解析
Klingler法を用いた白質解剖と、神経画像(Tractography, fMRI)を併用して、ヒト脳の神経束ネットワークをベースとしてヒトの認知機能を解析しています。
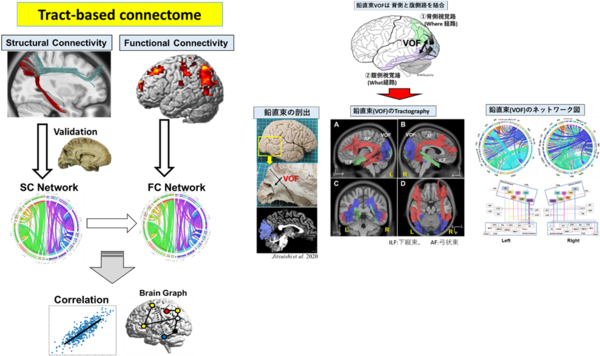
■これまでに、背側視覚路と腹側視覚路を結ぶ連合線維束である「鉛直束VOF」、頭頂間溝(IPS, intraparietal sulcus)と紡錘状回(FG, fusiform gyrus)を結合する「IPS-FG」を同定し報告 。
●Tatsuya Jitsuishi, Atsushi Yamaguchi
Identification of a distinct association fiber tract "IPS-FG" to connect the intraparietal sulcus areas and fusiform gyrus by white matter dissection and tractography
Sci Rep. 2020 Sep 23;10(1):15475.
●Jitsuishi T, Hirono S, Yamamoto T, Kitajo K, Iwadate Y, Yamaguchi A.
White matter dissection and structural connectivity of the human vertical occipital fasciculus to link vision-associated brain cortex.
Sci Rep. 2020 Jan 21;10(1):820. doi: 10.1038/s41598-020-57837-7.
●Tatsuya Jitsuishi, Atsushi Yamaguchi
Posterior Precuneus is Highly Connected to Medial Temporal Lobe Revealed by Tractography and White Matter Dissection
Neuroscience. 2021 Jul 1;466:173-185
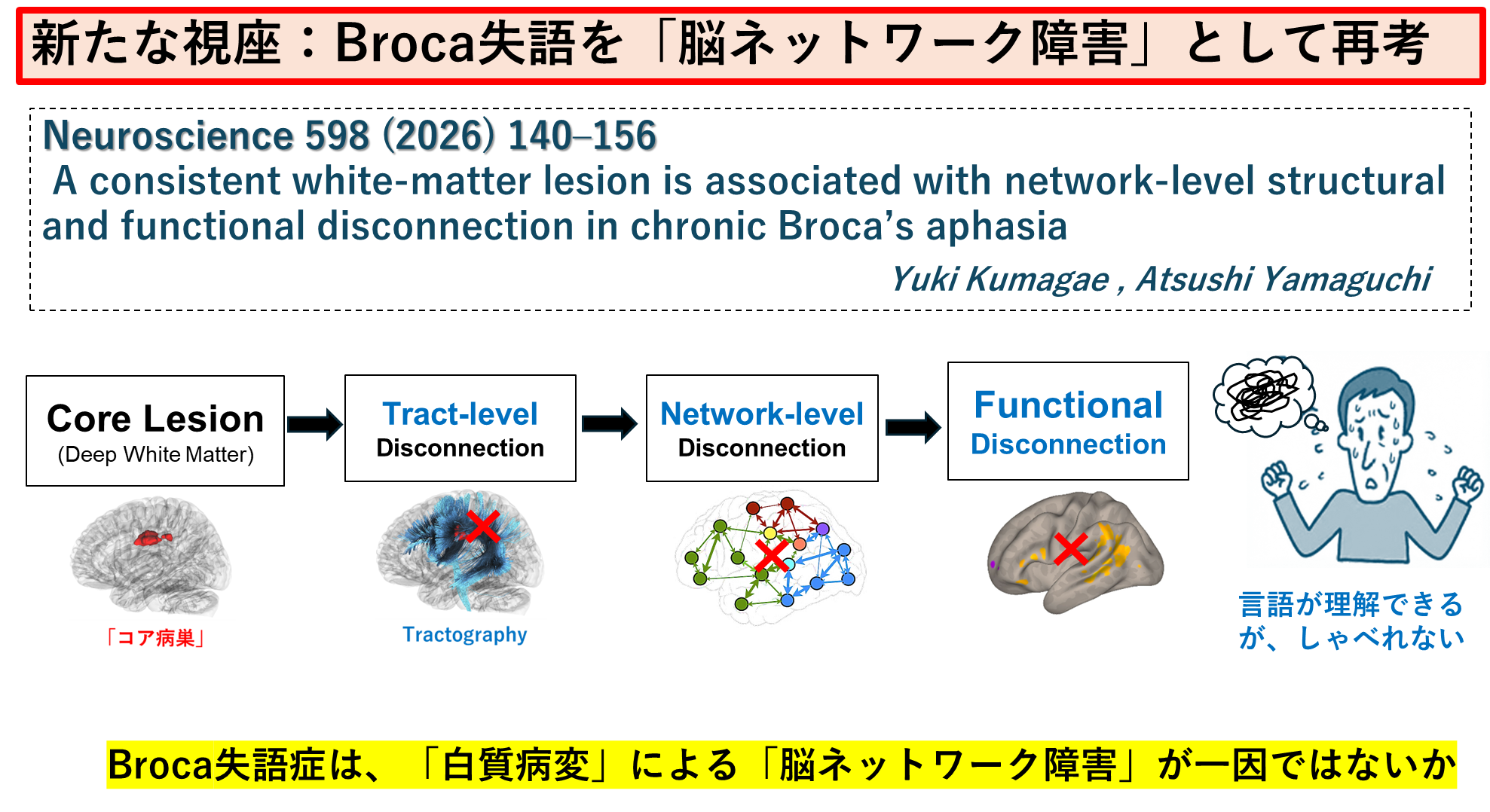
④ Broca's Aphasiaは「深部白質の病巣」による機能障害が運動性失語のネットワーク障害と関連することを報告しました。
◆脳梗塞の病態解明 --- 脳梗塞後の遷延性脳内炎症と瘢痕微小環境------
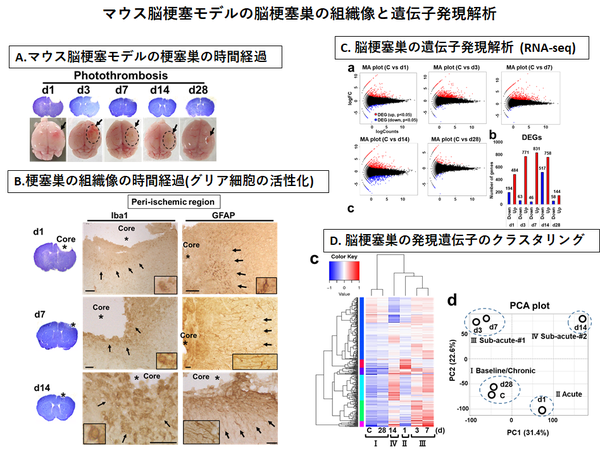
①脳梗塞 急性期における神経細胞のストレス応答機構の解明
②脳梗塞 亜急性期~慢性期の慢性炎症の病態と意義
●Atsushi Yamaguchi, Tatsuya Jitsuishi, Takashi Hozumi , Jun Iwanami, Keiko Kitajo, Hiroo Yamaguchi, Yasutake Mori, Masaki Mogi, Setsu Sawai
Temporal expression profiling of DAMPs-related genes revealed the biphasic post-ischemic inflammation in the experimental stroke model
Mol Brain. 2020 Apr 7;13(1):57. doi: 10.1186/s13041-020-00598-1.
●Muneki Sakamoto, Yuta Miyazaki, Keiko Kitajo, Atsushi Yamaguchi
VGF, Which Is Induced Transcriptionally in Stroke Brain, Enhances Neurite Extension and Confers Protection Against Ischemia In Vitro
Transl Stroke Res. 2015 Aug;6(4):301-8.
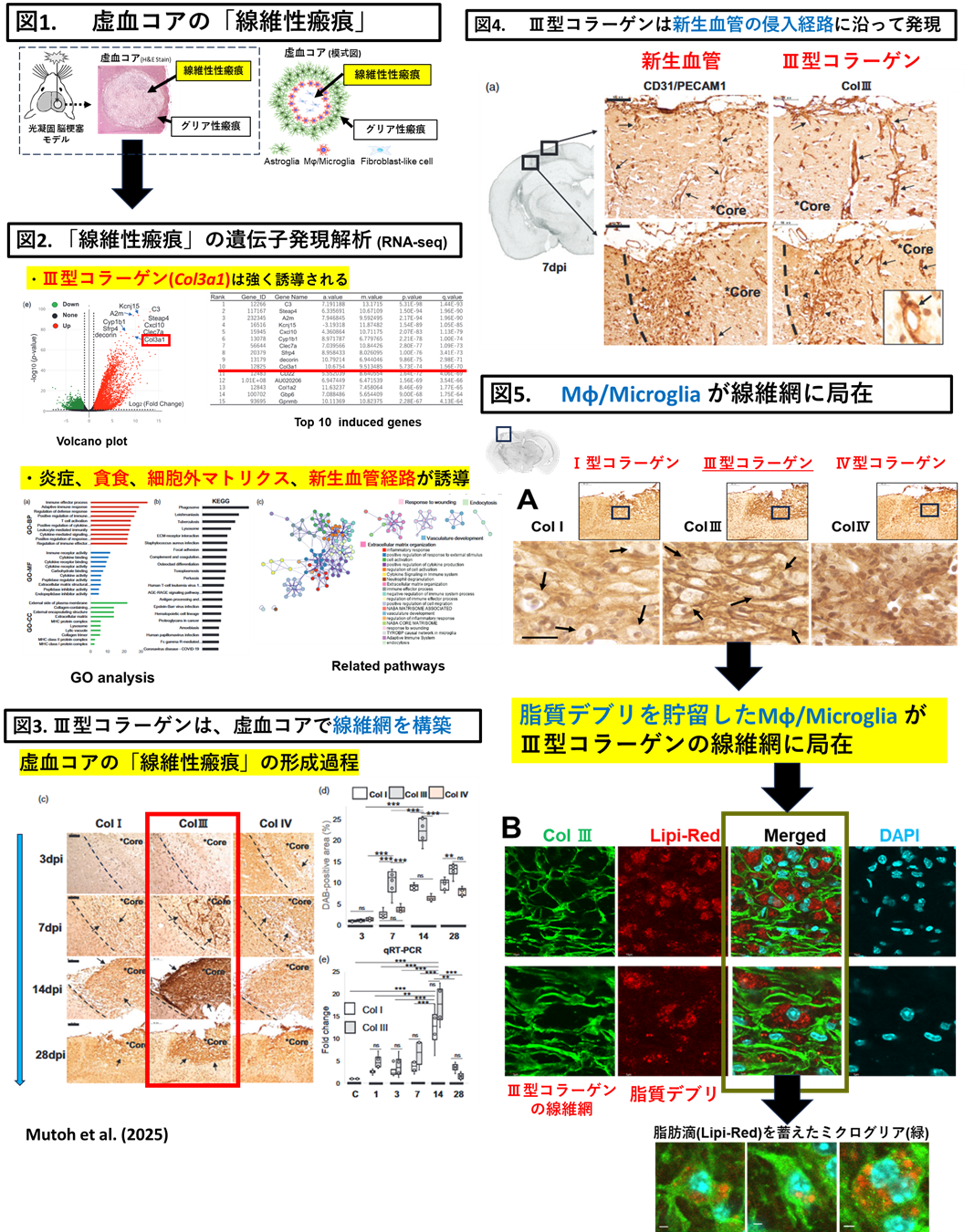
③Ⅲ型コラーゲンが「動的な足場」として血管再構築やMφ/Microgliaのデブリ貪食機構への関与
・脳梗塞の予後改善には、発症後早期の血流再開に加え、損傷組織の修復促進が不可欠です。近年、血管新生や炎症制御における細胞外マトリクス(ECM)の役割が注目されるが、脳特異的な動態や修復機構の分子レベルでの理解は乏しい。当研究室は、脳梗塞後の瘢痕微小環境において、代表的なECMであるⅢ型コラーゲンが、虚血コアに線維網を構築し、血管再構築やミエリンデブリを貪食したミクログリアの「動的な足場」として機能する可能性を報告しました。
・以下の2点を研究対象にしています。
-髄膜からコア領域に侵入する新生血管(Sprouting angiogenesis)におけるⅢ型コラーゲンの「動的な足場」としての機能
-ミエリンデブリを貪食するMφ/Microgliaの貪食機構とⅢ型コラーゲンの「動的な足場」としての機能
*参考文献
J Cereb Blood Flow Metab. 2025 Aug 13:271678X251366820. doi: 10.1177/0271678X251366820. Online ahead of print.
Dynamic expression of type III collagen in the lesion core of post-ischemic brain colocalizing with angiogenesis and lipid droplets during fibrotic scar formation
T Mutoh, K Kitajo, A Yamaguchi
■脳梗塞後の瘢痕微小環境における「動的な足場」 -Ⅲ型コラーゲンの虚血コアの線維網-
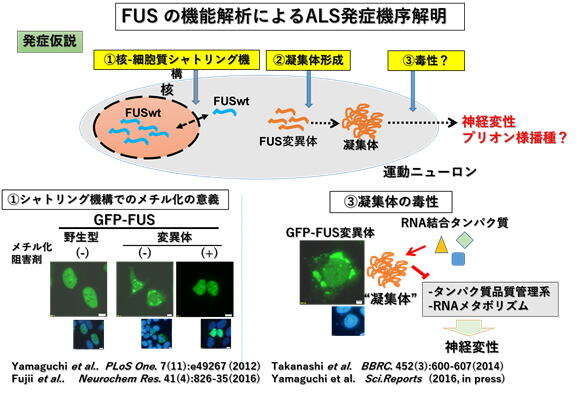
◆筋萎縮性側索硬化症(ALS)の発症メカニズムの解明
2009年に報告された常染色体優性遺伝性の家族性ALSの原因遺伝子FUS/TLSの機能解析によるALS発症機序の解明を行っている。
下図に示すように、3点を重点的に解析している。
①FUS/TLSの核‐細胞質シャトリング機構におけるアルギニンメチル化の意義
②FUS/TLSのC端NLS(核移行シグナル)の変異体の細胞質における病的凝集体の形成機序
③FUS/TLSのC端NLS変異体の病的凝集体の意義(Phase transition 相転移との関連)
❖生殖生物医学
生殖生物医学グループは、生殖細胞の発生・分化・成熟から受精・初期発生に至る現象の解析と不妊症発症機構の解析をメインテーマとして分子細胞生物学的研究を行っています。また、電顕センター(形態センター)を管理し、電子顕微鏡や共焦点レーザー顕微鏡等のメンテナンスや講習会を行い、学内の形態研究を支援しています。
生殖細胞現象に関しては、微細構造レベルを含めて解析できる研究室が国内では減少し、全世界を見回しても少なくなりました。当グループは、精子研究に関しては約50年の歴史を有しています。さらに、受精現象に関する電子顕微鏡レベルの画像を豊富に有し、これらをもとに分子生物学的観点から解析を進めている点が特徴です。また、学内外の研究機関から生殖細胞以外の組織・細胞の微細構造解析の依頼も受けて共同研究を行っています。
以下に研究対象や手法そして実際の研究例を紹介します。
【1】研究対象と手法の概要
1.CRISPR/Cas9システムを用いた遺伝子改変マウスの作製と受精機能分子の解析
ほ乳類の精子は、受精時に卵子と膜融合を行う前に、先体反応と呼ばれる精子細胞膜と外先体膜の膜融合を行います。その過程では、特定の時期に特定の分子が機能します。当教室は、この一連の現象の過程で機能する分子の動きを可視化することによって、膜融合のダイナミズムを解析しています。その解析法の一つとして、ターゲット遺伝子の変異体(GFP等の遺伝子導入:Tg)や遺伝子欠損(KO)マウスを作成し、特異的な分子の遺伝子やその産物の機能発現過程を可視化し、解析しています。現在、受精に関与する遺伝子Tg・KOマウスを作製・解析するとともに、CREST「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」鞭毛・繊毛をターゲットとする細胞の構造生命科学(代表:東京大学吉川教授)の千葉大メンバーとしてKOマウス作製とその解析を担当しています。
2.イメージング技術を用いた生殖細胞機能発現の解析
当グループは、GFP遺伝子導入した変異マウスを用いて、生殖細胞の形成・発生・分化・成熟から受精・初期発生・着床に至るまでを追跡できるシステムを有しています。ビデオレートレベルの撮像の早さと高感度高性能を有しかつ安定したカメラシステムを揃えています。また、GFPに加えてHoechstやDAPIも解析できるように共焦点顕微鏡システムにUVレーザーを導入しています。
3.電子顕微鏡による微細構造レベルの解析とライブイメージング
実験として体外受精下で機能解析を行うとしても、精子や卵子の機能発現は本来は体内で非常に迅速かつ細胞の微細なところから始まります。そのため、高解像蛍光顕微鏡を用いて目的分子の発現を確認した後、免疫金コロイドによる免疫電子顕微鏡を用いた分子レベルの解析をルーチーンに行っています。また、蛍光イメージングによる一分子レベルの可視化が可能となったため、電顕解析によって得た知見をもとにして、多重蛍光ライブイメージングに取り組んでいます。
4.精子形成機構とその破綻(精子形成異常による不妊症)の解析
精巣において毎日数千万もの精子が作られる精子形成過程では、男性ホルモンの影響下で様々の遺伝子が発現しています。精細胞はセルトリ細胞に支持され栄養されながら相互作用し、時間空間的に厳密に制御されて発生します。従って、遺伝子に異常が起こると、それに関わる制御が破綻し、精巧な精子構造の異常(奇形や機能異常)が誘起され、その結果不妊となります(雄性不妊)。精子形成に関わる固有の遺伝子、タンパク質そして細胞・組織の変化を解析し、不妊症の原因解明とその治療法の開発を目指しています。
5.精子成熟と輸送機構とその破綻(精子成熟から輸送異常による不妊症)の解析
精子は精巣上体管内を通過中に機能的に成熟し、射精された後に子宮から卵管膨大部へと上昇し卵子と出会います。精子は卵透明帯の上で卵を活性化するための準備primingを行います。受精過程では、精子は先体反応を行う際にexocytosisにより細胞内分子を放出し、その後に卵子と膜融合を行います。膜融合により卵子(卵母細胞)が活性化されると、減数分裂が再開し、受精卵は胚子となって初期発生へと向かいます。これら一連の過程で連続的に起こる形態変化をイメージングしながら、分子の相互関係を解析しています。
以上述べましたように、当グループは、精子形成過程から初期発生に至る情報の流れと形態変化とその破綻現象を解析することによって、不妊症の診断や治療、正常な発生の補助や異常発生の防止に貢献したいと考えています。
【2】研究例
1.精子微細構造と特異分子
当グループが解析を進めている精子特異的な分子は、自分達で発見し解析してきたequatorin (MN9), MN13, sperm CD9, MC101, MN7 (acrin1), sgp54 (T21, MC71, MC81, MC91, MC121)等です。そのうち、equatorin (MN9), MN13, MC101, MN7(acrin1)は、先体反応、精子-卵子膜接着そして卵子活性化等に関わります。Sgp54 は精巣上体内成熟と精子防御に働いています。
1)Equatorin (MN9)
エクアトリンEquatorin(Eqtn, MN9)は広く哺乳類精子に存在し、マウスでは第4染色体、ヒトでは第9染色体(9p21)に存在する遺伝子でcodeされているタンパク質です。Equatorinは精子形成過程で精子先体膜に配備され、成熟精子にも存在します。当グループはこれまでに、抗equatorin抗体MN9がin vivoおよびin vitroにおいて受精過程を阻害することから、equatorinが受精に関与することを報告してきました。最近では、equatorinが1型シアロ糖膜タンパク質(N-,O- sialoglycoprotein)であること、先体反応時に卵-精子膜融合部である赤道部細胞膜に移動すること、先体反応進行のマーカーとなることを報告しました(Yamatoya et al., 2009; Yoshida et al., 2010)。さらに、高解像蛍光顕微鏡と超顕微鏡STED nanoscopeを用いて、新しく作製したEquatorin-EGFPトランスジェニックマウスの解析と正常マウスのMN9抗体を用いた免疫電顕による解析を行い、equatorinが先体膜へ組み込まれる過程を明らかにしました。その結果、equatorinが先体膜とその周囲の基質と複合体を形成していることが示唆され、これに相応した新しい名称 (COMAM, CIMAM, CAMM)を提唱しました (Ito et al., 2013)。Equatoinは、精子形成期から受精に至る過程における先体膜や精子細胞膜の動態や機能を解析する上で指標となる有用なタンパク質であり、現在、他の受精関連タンパク質(Izumo1, SPACA1, SPESP1等)との相互作用を解析中です。さらに、ヒト不妊症精子の解析から、抗equatorin抗体は精子の質を診断するマーカーになると考えられ、当グループ所有の他の抗体と組み合わせて臨床応用(精子の質の検査)を検討しています。現在、Equatorin -EGFP トランスジェニックマウスやEquatorin-KO マウスを用いて、先体反応や卵子との膜融合そして卵活性との観点から、IZUMOとCD9やbasiginとの関係を含めた詳細な解析を行っています。
2)Sperm CD9
CD9は、卵子側の膜融合タンパク質(egg CD9)として知られています。しかし、CD9は精巣でも発現し、精祖細胞の細胞質に局在することが知られていましたが、成熟精子には存在しないと考えられていました。当グループでは、CD9(sperm CD9)が精子先体に局在し、卵透明帯通過後の囲卵腔や卵細胞上に到達した精子にも残存していることを世界で初めて報告しました(Ito et al., 2010b、成育医療研究センターとの共同研究)。CD9-KOマウスの解析から、sperm CD9は卵子との膜融合には関与しないとの実験結果がありますが、その機能は現在のところ不明です。
3)sgp54 (T21, MC71, MC81, MC91, MC121)
Sgp54は、糖鎖末端にシアル酸を有する54Kシアロ糖タンパク質であり、単クローン抗体T21, MC71, MC81, MC91そして MC121によって、特異的に認識されます(Toshimori et al., 1992; Katagiri et al., 2011)。Sgp54は、マウス精巣上体遠位頭部にある上皮細胞で産生され、細胞質頂面からexocytosisされて精巣上体管腔内に入り、通過中(成熟中)の精子細胞膜表面に結合します。精巣上体上皮から分泌される物質は従来、epididymosome として知られており、それらは被覆抗原coating antigen として機能し、精子活性を抑制し、精子を防御すると考えられていました。代表的なタンパク質として、ヒトとサルではbeta-defensin126、マウスではbeta-defensin 22(54K)が知られています。その糖鎖が重要と考えられていますが、現在のところその構造や機能は全く不明です。当教室で保有している単クローン抗体T21, MC71, MC81, MC91, MC121はsgp54(54Kタンパク質)を認識しており、beta-defensin 22(54K)に対する抗体である可能性が高いため、現在解析中です。
4)MN13とホスホリパーゼCz(PLCz)
卵活性化に至るシグナル伝達系として、ホスホリパーゼCゼータ(PLCz)やイノシトール1,4,5-三リン酸(PI3)経由が想定されており、それを支持する実験結果が蓄積されています。精子がPLCzを卵子に持ち込むと考えられていますが、精子内の局在については十分な証拠がありません。光顕的には精子頭部の後半部(先体後領域)に局在すると考えられています。PLCzを欠損させると、そのホモマウスの精子形成が障害されるため、卵活性化との関係は不明のままです。当教室で研究を進めている単クローン抗体MN13の抗原分子MN13は、精子頭部の後半部(先体後領域)に局在します。当教室では、この分子がマウスおよびヒト精子頭部の扁平化と先体後部形成に関係し、卵活性化能と関連することを示しました(Ito et al., 2009)。さらに、ヒトとマウスのMN13の発現時期と精子内への配備経路を明らかにし、精子細胞が卵活性化能を獲得する時期と関連があることを示しました(Ito et al., 2010a)。MN13の抗原分子の性状は現在解析中ですが、抗MN13抗体自体が卵活性化に関する先体後領域の優れたマーカーとなるため、正常ヒト精子とヒト不妊症患者精子を用いて、equatorin (MN9)とMN13の共存をイメージングした精子の質の評価法を開発中です。
5)ODF2
ODF2は、精子尾部構成タンパク質として発見されましたが、現在では中心体に普遍的に存在するタンパク質であることが判っています。当グループでは、ODF2の機能解析のために新規に作製したODF2遺伝子欠損ヘテロマウスが不妊であり、その原因が精子頸部の脆弱性であることを明らかにしました。また、精子形成期におけるODF2と他の中心体関連タンパク質との相互関係をwestern blot法とreal-time PCR法により解析し、培養細胞にてODF2 のisotypeの相互作用を解析しました。現在、ODF2-EGFP トランスジェニックマウスを用いて受精時における機能解析を進めています。
6)ベイシジンbasigin
ベイシジンbasigin (CD147/EMMPRIN)は、精巣や精子に発現する免疫グロブリンスーパーファミリー(IgSF) 膜糖タンパク質であり、神経、心臓、胎盤、精巣など多くの組織で発現し、広範な機能を持つことが知られています。Basigin遺伝子欠損マウスは、精子形成が減数分裂で停止します(meiosis arrest)(Chen et al., 2004)。野性型精子では、精子形成→精子成熟→受精能獲得→先体反応→受精へと進むにつれて、ベイシジンの局在や分子量が変化することから、特定の部位で切断されることにより機能発現していると考えられます。現在、ベイシジンの機能を知るため、ベイシジンと相互作用する分子を免疫沈降法や質量解析法などを用いて探索中です。
7)Izumo1とegg CD9
配偶子膜融合関連タンパク質として、IZUMO(精子側)とCD9(卵子側)が知られており、多くの研究室でそれぞれの遺伝子欠損マウスを用いた解析が進められています。当グループでは、egg CD9が卵子から分泌されるexsosomeに含まれることを免疫電顕を用いて世界で初めて示しました(Miyado et al., 2008、成育医療研究センターとの共同研究)。IZUMOはequatorin との関係で解析中です。
2.雄性不妊に関わる遺伝子の解明
1)タンパク質輸送の破綻による円形頭部精子症:GOPC遺伝子欠損マウス
以前、がん研究会がん研究所との共同研究で、ゴルジ装置関連PDZ-coiled coil motif含有タンパク質をコードするGOPC遺伝子が欠損すると、ゴルジ装置由来の小胞の融合や輸送が障害される結果、ホモ雄マウス精子が円(球)形頭部になり不妊になること、そしてその原因は、先体が欠損することにより先体反応ができなくなり、精子が卵子に進入できなくなるためであることを証明しました(Yao et al., 2002、癌研野田研との共同研究)。その後、GOPC遺伝子欠損マウス精子とヒト円形頭部精子症患者の精子を用いて、先体の欠損に伴って起こる核周囲物質(卵子活性化因子を含む)の消失過程をICSI(卵子内精子微小注入)法による機能解析を併用して解析しました。その結果、精子の先体後領域の構造(先体後部鞘)と核周囲物質MN13の存在が卵活性化に重要な役割を持つこと、従って、抗MN13抗体が精子の質の評価に役立つことを示しました(Ito et al., 2010、)。
2)Apoptosis-associated tyrosine kinase (Aatyk) family分子欠損による無精子症:Brek遺伝子欠損マウス
Brek/Lmtk2 (brain-enriched kinase/lemur tyrosine kinase 2)は、Aatyk familyに属するserine/threonine kinaseであり、マウス新生児脳に高レベルに発現し、in vitroでは神経成長因子(NGF)シグナル伝達に関わるタンパク質として知られています。Brek遺伝子欠損マウスは、Aatyk family で初めて作製された遺伝子欠損マウスであり、そのホモ雄は無精子症となり不妊となります。私たちは、この遺伝子欠損マウス精子の形成異常が中期円形精子細胞期から始まり、伸長期精子細胞期では精細胞-セルトリ細胞特殊接合装置の形成不全と消失が起こり、その後、ほとんどの伸長期精子細胞が変性してセルトリ細胞に貧食される結果、無精子症になることを証明しました(Kawa et al., 2006、東大医科研山本研との共同研究)。
3)免疫グロブリンスーパーファミリー分子欠損による乏精子-無力精子-奇形精子症:RA175遺伝子欠損マウス
RA175 (necl2/TSLC1/SynCAM1/IGSF4A/SGIgSF)は、シナプスや上皮細胞の細胞接着に重要な役割を担っている分子です。精巣では、特定のステージの造精細胞に存在します。RA175遺伝子欠損オスマウスは、乏精子・無力精子・奇形精子症を呈し、雄性不妊となります。精巣上体頭部の管腔内には未熟な造精細胞が多く見られることから、RA175は造精細胞の接着に関与し、その維持に重要な役割を果たすことを示しました(Fujita et al., 2006; Maekawa et al., 2011、精神・神経医療研究センターとの共同研究)。
4)GalNAc転移酵素ファミリー分子欠損による乏精子・無力精子・奇形精子症:Galnt3遺伝子欠損マウス
Galnt3 (UDP-N-acetyl-a-D-galactosamine: polypeptide N-acetylgalactosaminyl- transferase 3)は、ムチン型O結合型糖鎖生合成の第一段階において、N-アセチルガラクトサミンをセリンまたはスレオニン残基のヒドロキシル基へ転移させる酵素です。Galnt3遺伝子が欠損するとオスは不妊となります。その原因は乏精子・無力精子・奇形精子を形成することにありました。さらに、Galnt3遺伝子欠損精子の先体は、equatorinの糖鎖部を認識するMN9抗体に反応しないことを見出し、Galnt3がequatorinのO結合型糖鎖生合成に関与していることを示しました(Miyazaki et al., 2013、長崎大学小守研との共同研究)。
5)超長鎖脂肪酸代謝に関わる分子欠損による奇形頭部精子症:Tysnd1遺伝子欠損マウス
Tysnd1 (Trypsin domain containing 1)はペルオキシソームに局在し、超長鎖脂肪酸のβ−酸化に関わる代謝酵素群を切断して活性化するペルオキシソームプロセッシングプロテアーゼです。Tysnd1遺伝子を欠損する雄マウスは不妊となります。その原因は精子頭部奇形であることを証明しました(Mizuno et al., 2013、埼玉医大岡崎研との共同研究)。
6)その他の遺伝子改変不妊マウスの解析
上記以外に、以前報告しました、核関連異常による多形精子化−GCL遺伝子欠損マウスの解析(Kimura et al., 2003、大阪大学仲野研との共同研究)、セルトリ細胞関連分子の異常による乏精子・無力精子・奇形精子症−Cnot7(CAF1)遺伝子欠損マウスの解析(Nakamura et al, 2004、東大医科研山本研との共同研究)、SMAP2遺伝子欠損マウス(東北大学加齢研佐竹研との共同研究)、Galnt5遺伝子欠損マウス(産総研成松研との共同研究)、ORP4遺伝子欠損マウス(東京大学薬学新井研の共同研究)、Slc22a14遺伝子欠損マウス(静岡大学与語研との共同研究)など、解析進行中のプロジェクトを含めて多数あります。
3.臨床応用
1)精子の質を評価する方法の開発
ヒトの不妊症は、全世界でカップルの10~15%位で起こり、その原因は男性と女性で1:1に近くなっていると思われます。ヒト精液中の精子の約半数は、何らかの異常をもっていると考えられます。その異常は、受精障害を起こすだけでなく、受精した場合には次世代にも影響するのではないかというデータが数多く発表されています。そこで、当グループでは、精子の質を評価するための方法とその基準作りを行っています。精子の解析には、精子構造(電子顕微鏡レベル)と機能分子(遺伝子・タンパク質レベル)に対する知識が必要です。現在、学外の生殖医療施設と共同しながら、精子形態(特に頭部空胞)、精子核DNA(DNAの断片化)そして受精機能タンパク質(MN9とMN13抗体の応用)を指標にした精子の質の評価法を開発する研究を進めています。
2)避妊ワクチンの開発
精子成分に対する他の単クローン抗体の解析を通して、避妊ワクチンの開発を目指しています。